Опубликовано: Июль 1, 2011
Некоторые данные о соединениях углерода и составе древесины Древесина в наших условиях - это неисчерпаемый источник для получения самых разнообразных веществ. Древесный уголь, сажа, смола, масла, канифоль, фенол, скипидар, деготь, растворители, уксусная кислота, этиловый и метиловый (древесный) спирты, глюкоза, ацетон, дубильные вещества, целлюлоза, бумага, картон, рубероид, кино- и фотопленка, линолеум, фибра, искусственный шелк и штапель, древесноволокнистые плиты, гранитоль, дерматин, искусственный мех, пластмассы, лекарственные соединения, камфара, витамины, ванилин, лаки, клеи, бездымный порох, кормовые дрожжи, литейные крепители и много других соединений получаются в результате химической переработки древесины. Конечно, такие вещества, как ацетон, фенол, уксусная кислота и пр., могут быть получены более экономичным способом, а именно синтезом из других источников сырья. О том, что может дать химическая переработка древесины, что выпускает промышленность и где применяются перечисленные выше и многие другие вещества, и рассказано в этой книге.
Вспомним, какие органические соединения входят в состав древесины, как они построены и какими методами химики преобразуют их в нужные для народного хозяйства материалы. 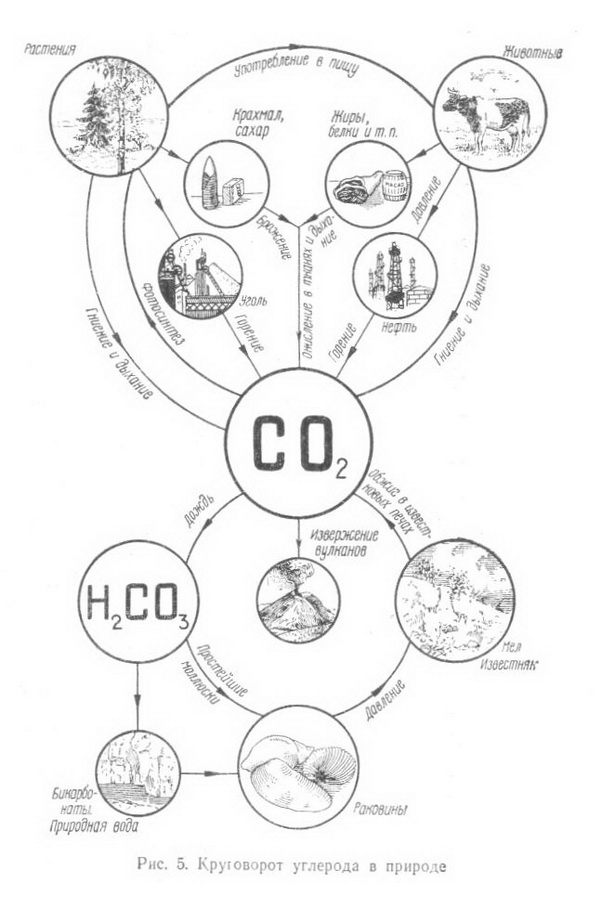 Окружающий нас органический и неорганический мир представляют неисчерпаемую «копилку» различных соединений, каждое из которых состоит из мельчайших частичек (молекул), сохраняющих все химические свойства данного вещества. Размер их настолько мал, что если бы мы имели в своем распоряжении столько кирпичей, сколько молекул находится в одном кубическом сантиметре воздуха, то мы смогли бы покрыть всю нашу планету слоем, толщина которого равнялась бы самому высокому зданию Московского университета. Каждая молекула состоит из еще гораздо более мелких частиц - атомов. О размерах молекул можно судить также по следующему примеру: если молекулы сахара, находящиеся примерно в 350 граммах, равномерно распределить по всей поверхности земного шара, то на каждый квадратный сантиметр суши и океана пришлось бы более чем по 120 000 молекул. В природе есть все необходимые вещества, которые с помощью химических процессов можно превратить в новые соединения и из них получить нужные материалы. Вековечной мечтой человечества является стремление воспроизвести в таких же мягких условиях, как и в природе, процессы, в результате которых из простейших веществ получаются такие сложные и всем известные соединения, как жиры и белки, целлюлоза и каучук, энзимы и протеины, сахара и спирты и др. В основе всех этих и сотен тысяч других соединений лежит углерод, который благодаря своим особым свойствам может соединяться почти со всеми остальными элементами. Уже сейчас органических веществ известно более 3 млн. 100 лет тому назад, в 1869 г., выдающийся химик Д. И. Менделеев в своей книге «Основы химии» писал «В состоянии соединений углерод входит в состав так называемых органических веществ, т. е. множества веществ, находящихся в теле всякого растения и животного. Он находится в виде углекислого газа в воде и воздухе, а в виде солей углекислоты и органических остатков в почве и массе земной коры. Разнообразие веществ, составляющих тело животных и растений, известно каждому. Воск и масло, скипидар и смола, хлопчатая бумага и белок, клетчатая ткань растений и мускульная ткань животных, винная кислота и крахмал - все эти и множество иных веществ, входящих в ткани и соки растений и животных, представляют соединения углеродистые. Область соединений углерода так велика, что составляет особую отрасль химии, носящую название органической химии, т. е. химии углеродистых или, лучше, углеводородистых соединений».  Уже само название углеводороды говорит о том, что эти соединения состоят из атомов углерода и водорода. Так как углерод четырехвалентен, то он может к своим четырем свободным связям присоединить четыре атома водорода. Метан - газ, который встречается в природе и известен под названием болотного газа. Можно написать эту же формулу и сокращенно СН4. Число атомов данного элемента в составе молекулы вещества обозначают цифрой, стоящей внизу, справа от наименования элемента. Например, молекула простого вещества - водорода, состоящая из двух его атомов, обозначается Н2, а сложного вещества воды - Н2О, так как ее молекула состоит из двух атомов водорода и одного атома кислорода. Молекулярный вес вещества равен сумме атомных весов всех элементов, составляющих молекулу. Зная атомный вес водорода (1) и углерода (12), можно легко найти молекулярный вес метана: 4x1 + 12=16. Так как атомы углерода могут замещать в молекуле атомы водорода и неограниченно соединяться между собой, то получается ряд соединений, каждое из которых отличается от предыдущего на группу СН2 (метилен). Подобная группа углеводородов, составляющая как бы «единую семью» и носящая название гомологического ряда (от греческого слова homos - общий, сходный, однозначащий), обладает сходными химическим строением и химическими свойствами. Это - насыщенные, или предельные, углеводороды, у которых все связи насыщены (заполнены). Но есть еще ненасыщенные, или непредельные, углеводороды, молекулы которых имеют меньшее число атомов водорода, чем насыщенные, но зато содержат одну или более двойных или дажетройныхсвязей. Если обозначить число атомов углерода в молекуле через п, то для любого гомологического ряда можно дать общую формулу. Например, гомологический ряд предельных углеводородов, ведущих свое начало от метана, может быть выражен общей формулой С„Н2п+2. 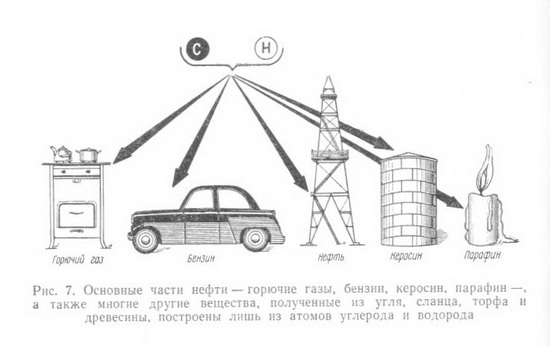 Цепи углеродных атомов отличаются друг от друга не только количеством углеродных атомов и наличием тех или иных связей, но н по форме, т. е. цепь может быть открытой (прямой и разветвленной) или закрытой, образующей кольцо (например, бензол, нафталин). Ненасыщенные углеводороды с открытой цепью, содержащие одну двойную связь, -олефины составляют другой гомологический ряд этилена СН2 = СН2; этот ряд может быть выражен общей формулой С„Н2„. Есть и другие гомологические ряды. Так, ненасыщенные углеводороды, имеющие две двойные связи, - диеновые углеводороды имеют общую формулу С„Н2,,-2. Представителем этого ряда является, например, бутадиен (дивинил) СН2 = СН - СН = СН2. 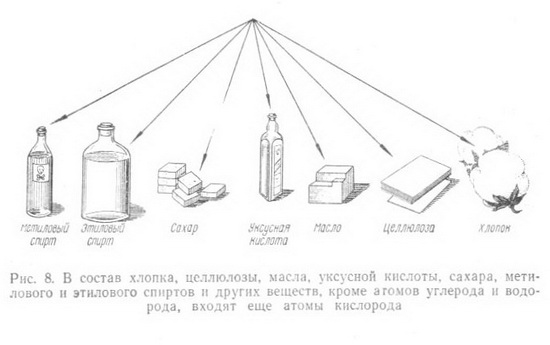 Ненасыщенные углеводороды с открытой цепью, содержащие тройную связь, составляют гомологический ряд ацетилена с общей формулой С2Н2-2. Атомы углерода в молекулах углеводородов перечисленных выше гомологических рядов образуют как прямые, так и разветвленные цепи. Среди них есть такие химические соединения, которые, имея одинаковый качественный и количественный состав, в то же время отличаются между собой по своему химическому строению, а также по физическим и химическим свойствам. Такие соединения называются изомерными веществами, или изомерами (от греческого слова isos - равный, одинаковый). Например, для углеводорода С4Н10 имеем: СНз - СН2 - СН2 - СН3. Это - нормальный бутан, температура плавления которого равна - 138,4° С, а температура кипения -0,5° С, и изобутан СН3-СН-СН3, температура кипения которого -11,7°С; температура плавления - 159,6°С. Для углеводорода состава СмНэд возможны 1858 изомеров. Овладение методами органического синтеза обеспечило мощное развитие новых отраслей химической промышленности, производящей сейчас тысячи различных соединений и в том числе такие сложные вещества, как антибиотики, витамины, половые гормоны и другие вещества, которые до последних лет получались только биологическим путем. Элементарный анализ показывает, что бензин, керосин, парафин, природный газ, ацетилен, каучук и многие другие вещества состоят из атомов углерода и водорода (рис. 7). В то же время древесина, уголь, целлюлоза, крахмал, сахар, уксусная кислота, спирт, глицерин, масло и многие другие известные и широко употребляемые продукты (рис. 8), кроме атомов углерода и водорода, содержат еще атомы кислорода (иногда небольшое количество атомов азота). Из всех известных органических соединении самыми сложными по своему составу и строению являются белки.  Уже многие тысячелетия тому назад люди стали использовать в пищу жиры и масла, извлекаемые как из животных, так и растительных организмов, а также сладкий сок сахарного тростника, клена, березы. Некоторые красящие и лекарственные вещества тоже добывались из растений и животных. Чем дальше шло человечество в своем развитии, тем все большее и большее количество органических соединений стало использоваться людьми и тем большее внимание этим соединениям стали уделять ученые. Тысячи вопросов возникли сразу же после того, как удалось получить искусственным путем (синтезировать) первые органические соединения. Из какого «строительного материала» состоят их молекулы? Все ли они могут быть получены одинаковым способом.' И многое, многое другое интересовало исследователей. Что же из себя представляла органическая химия в первой половине XIX в.? Об этом свидетельствует письмо Велера к своему учителю - известному шведскому химику Берцелнусу. Он писал в 1835 г., что органическая химия представляется ему дремучим лесом, полным чудесных вещей, огромной чащей, без выхода, без конца, куда не осмеливаешься проникнуть. И все же ученые не оставляли своих усилий пробраться в эту «чащу» и, разлагая природные соединения, старались по полученным остаткам судить о составе вещества. Проводником из этой «чащи», проложившим открытую и ясную дорогу, явился А. М. Бутлеров, разработавший теорию химического строения органических веществ (характер взаимосвязей атомов в молекуле, т. е. химическое строение веществ, определяет их физические и химические свойства), которой руководствуются химики всего мира и в наши дни. А. М. Бутлеров еще в 1864 г. подчеркивал, что можно ручаться за возможность синтетического получения каждого органического вещества. Открытие Д. И. Менделеевым в 1869 г. основного закона природы - периодического закона - и создание периодической системы химических элементов, столетний юбилей которого отметил весь мир в феврале 1969 г., является началом современной химии и химической промышленности. Уже в 1861 г. А. М. Бутлеров из формальдегида полимеризацией его в известковой воде впервые синтезировал сахаристое вещество.  Все разнообразные синтетические материалы: смолы и пластмассы на их основе, волокна, пленки и каучуки, несмотря на большое различие химического состава, строения и свойств, обладают одним общим признаком- все они построены из больших молекул, молекул-гигантов, содержащих от нескольких сотен до многих тысяч атомов. Высокомолекулярные соединения имеются и в природе. Это - белки, целлюлоза, крахмал, лигнин, натуральный каучук и другие соединения, играющие важную роль в жизнедеятельности растений и животных. Если молекула воды (Н20) состоит из трех атомов, поваренной соли (NaCI) из двух атомов, уксусной кислоты (CHjCOOH) из восьми атомов, свекловичного сахара (С12Н32О11) из 45 атомов, то молекула белка крови - гемоглобина - более чем из 9500 атомов, а число атомов в молекуле целлюлозы достигает 300 000. ( рис. 9)
прим. формулы могут быть искажены, смотрите источник источник: А. Авербух, "Что делает химия из древесины", Москва, издательство "Лесная промышленность", 1970 год
От: LidiaZaiceva,
Скрыть комментарии (отзывы) (0)
Похожие темы:
- Араукария Каннингема (Araucaria cunninghamii), дерево, свойства древесины
- Тасманский дуб (E. delegatensis, E. obliqua & E. regnans), дерево, свойства древесины
- Бекхаусия Бэнкрофта (Backhousia bancroftii), дерево, свойства древесины
- Жёлтый кедр (Chamaecyparis nootkatensis), дерево, свойства древесины
- Американский белый дуб (Quercus alba), дерево, свойства древесины
« Вернуться
|